Bài viết này sẽ cung cấp cho bạn khái niệm về C2H6O là gì và các công thức cấu tạo và các tính chất vật lý, hoá học của rượu Etylic C2H6O. Chúng ta cùng khám phá nhé!
1. C2H6O là gì?
C2H6O hay còn gọi là rượu Etylic là một chất lỏng không màu.
2. Tính chất vật lý của rượu Etylic C2H6O
- Rượu Etylic là một chất lỏng không màu và có điểm sôi ở 78,3°C.
- Rượu Etylic nhẹ hơn nước và tan vô hạn trong nước. Nó cũng hòa tan được nhiều chất khác như iot, benzen,…
- Độ rượu là số ml rượu etylic nguyên chất có trong 100 ml hỗn hợp rượu etylic với nước. Công thức để tính độ rượu là Độ rượu = (V rượu etylic / V hỗn hợp) x 100, trong đó V là thể tích đo bằng ml hoặc lít.
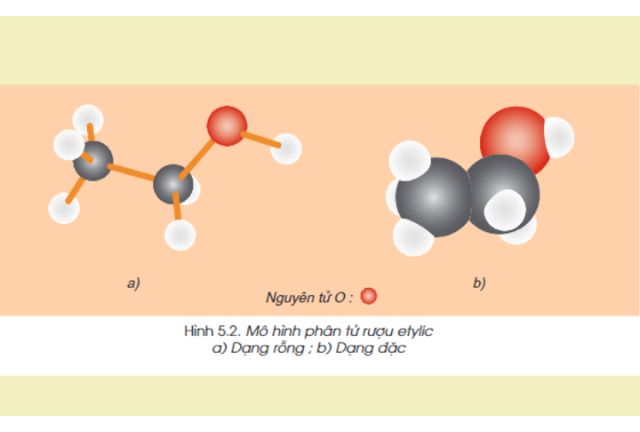
3. Cấu tạo phân tử của rượu Etylic C2H6O
Rượu Etylic C2H6O có công thức cấu tạo CH3-CH2-OH. Trong phân tử, rượu etylic có một nguyên tử H không kiên kết với nguyên tử C mà liên kết với nguyên tử oxi tạo ra nhóm -OH. Chính nhóm -OH này làm cho rượu có tính chất hoá học đặc trưng.
4. Tính chất hoá học của rượu Etylic C2H5OH
- Rượu Etylic C2H5OH tác dụng với oxi, phản ứng cháy: Rượu Etylic cháy với ngọn lửa màu xanh, toả nhiều nhiệt theo phương trình sau: C2H5OH + 3O2 → 2CO2 + 3H2O
- Rượu Etylic C2H5OH tác dụng với kim loại mạnh K, Na: Khi thả mẩu Na vào cốc đựng rượu Etylic, mẩu natri tan dần và có bọt khí thoát ra theo phương trình: 2C2H5OH + Na → 2C2H5ONa + H2↑
- Rượu Etylic C2H5OH phản ứng với axit axetic: Đổ rượu Etylic vào cốc đựng axit axetic với xúc tác H2SO4 đặc, tạo thành dung dịch đồng nhất. Đun nóng hỗn hợp một thời gian, trong ống nghiệm xuất hiện chất lỏng không màu, mùi thơm, không tan trong nước và nổi trên mặt nước theo phản ứng: C2H5OH + CH3COOH → CH3COOC2H5 + H2O
5. Ứng dụng của rượu Etylic C2H5OH
- Rượu Etylic được sử dụng làm nhiên liệu cho động cơ ô tô và đèn cồn trong phòng thí nghiệm.
- Nó cũng được sử dụng làm nguyên liệu sản xuất axit axetic, dược phẩm và cao su tổng hợp.
- Hơn nữa, rượu Etylic còn được dùng pha chế các loại rượu uống.
6. Điều chế rượu Etylic C2H5OH
Có hai phương pháp điều chế rượu Etylic C2H5OH:
- Điều chế rượu làm đồ uống bằng cách sử dụng tinh bột hoặc đường glucozơ.
C6H12O6 → 2CO2 + 2C2H5OH - Sản xuất rượu phục vụ ngành công nghiệp bằng cách cho etilen cộng hợp với nước với xúc tác là axit.
C2H4 + H2O → C2H5OH
7. Bài tập về rượu Etylic C2H5OH
- Bài 1 trang 139 sgk hoá 9: Rượu Etylic phản ứng được với natri vì:
Đáp án: Trong phân tử có nhóm -OH. - Bài 2 trang 139 sgk hoá 9: Chất tác dụng được với Na trong số các chất sau: CH3-CH3, CH3-CH2OH, C6H6, CH3-O-CH3 là chất Etylic. Phương trình hóa học:
2C2H5OH + 2Na → 2C2H5ONa + H2↑ - Bài 3 trang 139 sgk hoá 9: Cho Na dư vào ba ống nghiệm: ống 1 đựng rượu Etylic, ống 2 đựng rượu 96o và ống 3 đựng nước. Viết các phương trình hóa học.
Ống 1: 2C2H5OH + 2Na → 2C2H5ONa + H2↑
Ống 2: 2H2O + 2Na → 2NaOH + H2↑
Ống 3: 2H2O + 2Na → 2NaOH + H2↑ - Bài 4 trang 139 sgk hoá 9: Ý nghĩa của các số trên chai rượu là chỉ tỷ lệ rượu nguyên chất trong hỗn hợp. Ví dụ, 45o tức là trong 100ml có 45ml rượu etylic nguyên chất.
Số ml rượu etylic trong 500ml chai rượu 45o là 225ml.
Số ml rượu 25o pha chế được từ 500ml rượu 45o là 900ml. - Bài 5 trang 139 sgk hoá 9: Đốt cháy hoàn toàn 9,2g rượu etylic. Thể tích khí CO2 tạo ra ở điều kiện tiêu chuẩn là một vấn đề cần tính toán.
Với các tính chất và ứng dụng đa dạng, rượu Etylic C2H5OH đã trở thành một chất quan trọng trong nhiều lĩnh vực và đời sống hàng ngày của chúng ta.